| T.P : Photosynthèse |
- Membrane Externe
- Membrane Interne
- Membrane thylacoide

- La phase lumineuse : l’énergie apporté par les photons conduit à la réduction du NADP+ en NADPH. Il y a une création d’une force proton motrice qui va permettre la synthèse d’ATP.
- La phase obscure va conduire à la réduction du CO2
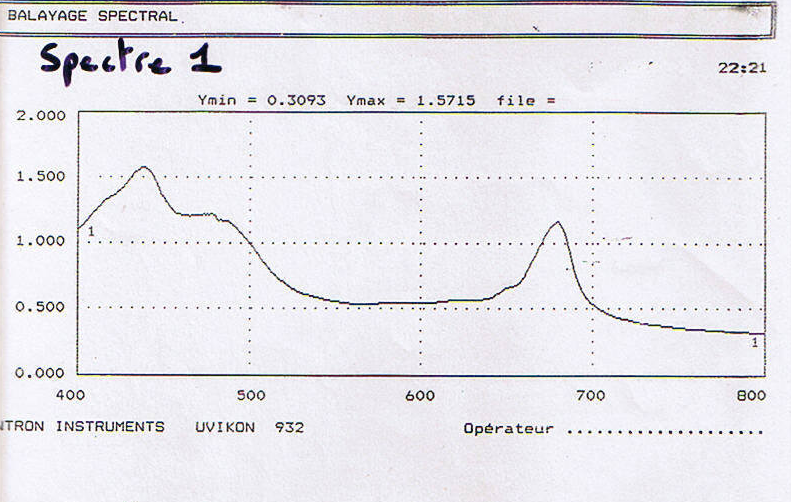
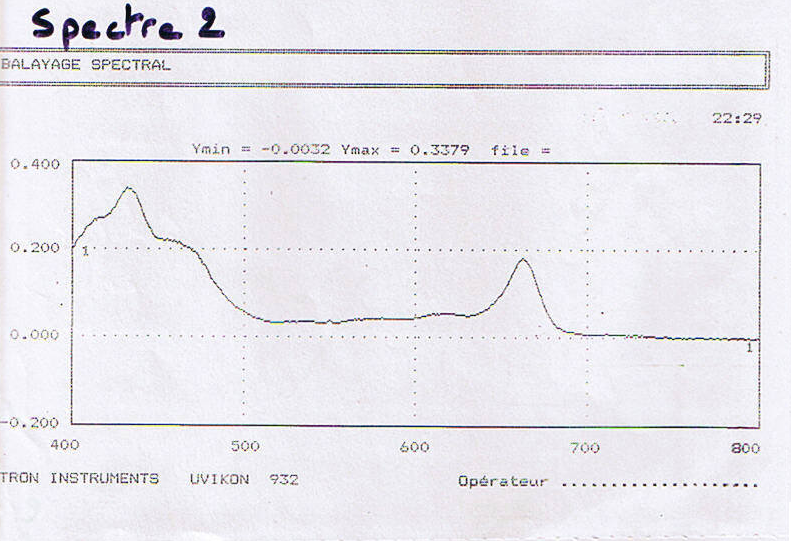
| Longueur d’onde ( Lamba en nm ) | Absorbance |
| 652 | 0.125 |
| 663 | 0.233 |
| 645 | 0.078 |
[chl] = 0.125 / 36 = 3.47 10-3
- [chl] = DO652 / 36
[chl a] = 0.0127 x 0.233 – 0.00269 x 0.078 = 2.7 -3
- [chl a] = 0.0127 DO663 – 0.00269 DO645
[chl b] = 0.0229 x 0.078 – 0.00468 x 0.233 = 6.95 10-4
- [chl b] = 0.0229 DO645 – 0.00468 DO663
12 cm --> 1 minuteDonc 0.0435 / 0.85 = 0.051 µmol / ml [O2] / min
10.2 cm --> 0.85 minute
| Conditions | Activité ( micromol / min [O2] / mg [chl] ) |
| Avec Ferricyanure | 0.67 |
| Avec DCBQ | 0.13 |
| Avec Ferricyanure + DCBQ | 0.34 |
| Avec Ferricyanure + DCBQ + DCMU | 0.15 |